按照《国家药监局关于发布〈中药注册分类及申报资料要求〉的通告》要求,古代经典名方中药复方制剂由专家进行技术审评。国家药品监督管理局、国家中医药管理局(以下简称两局)共同组建古代经典名方中药复方制剂专家审评委员会,对该类制剂的审评提供技术支持和决策建议。
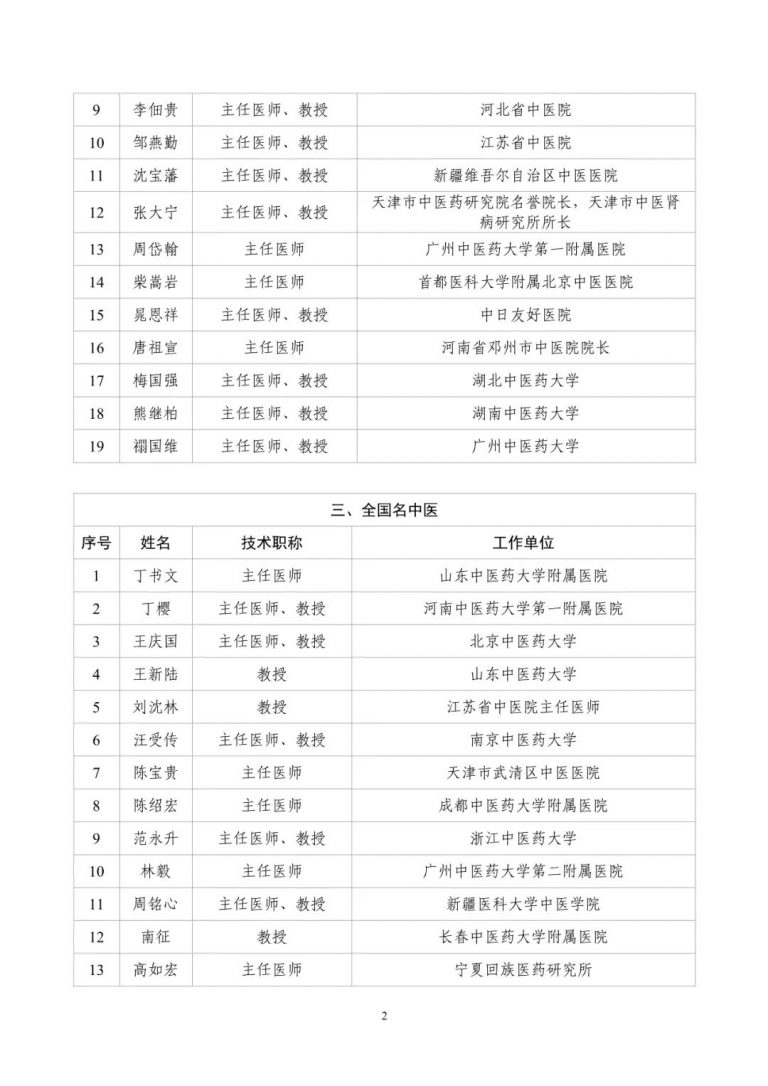
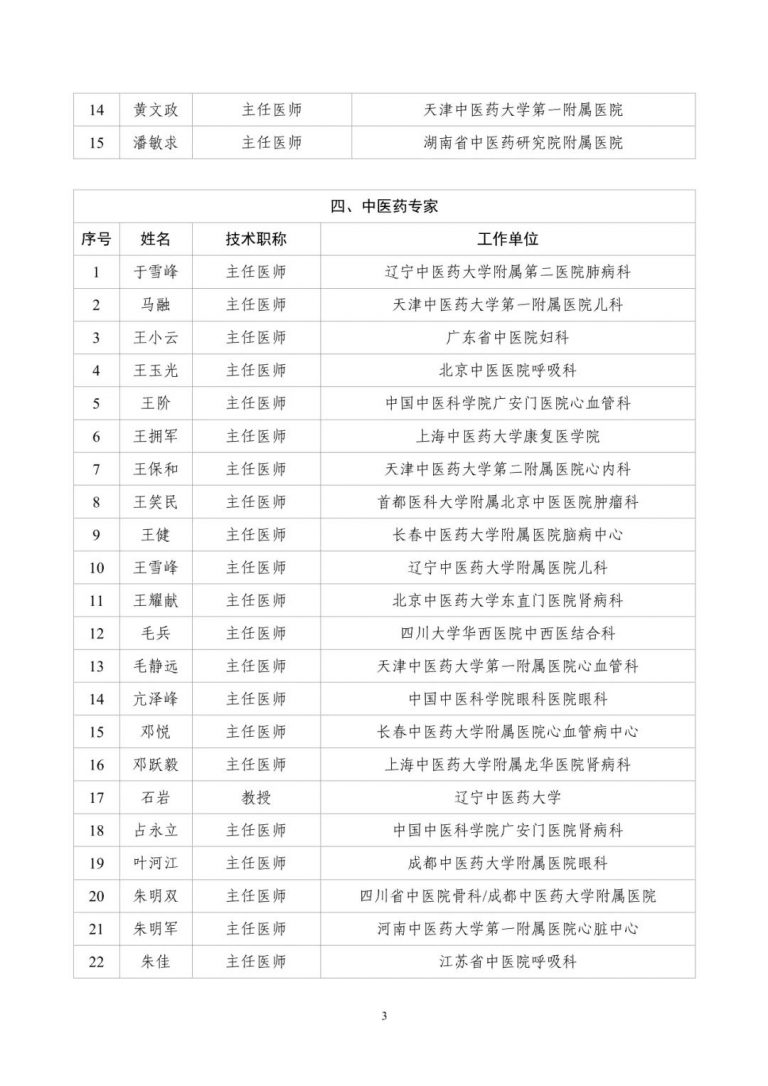
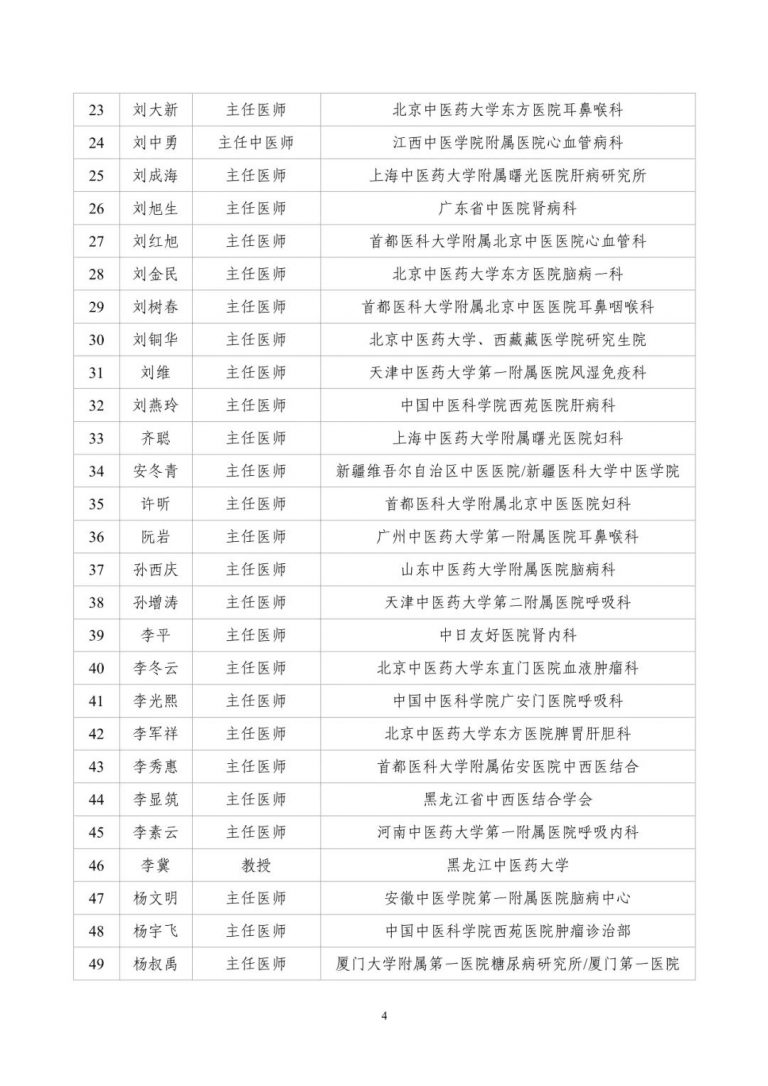
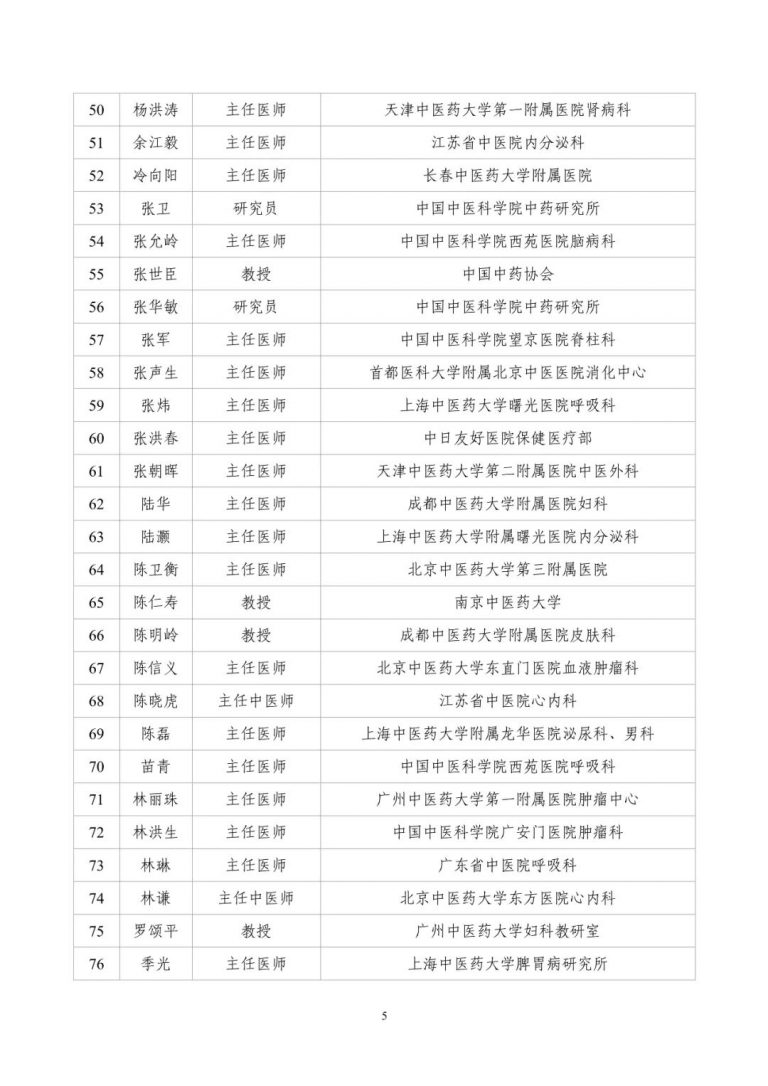
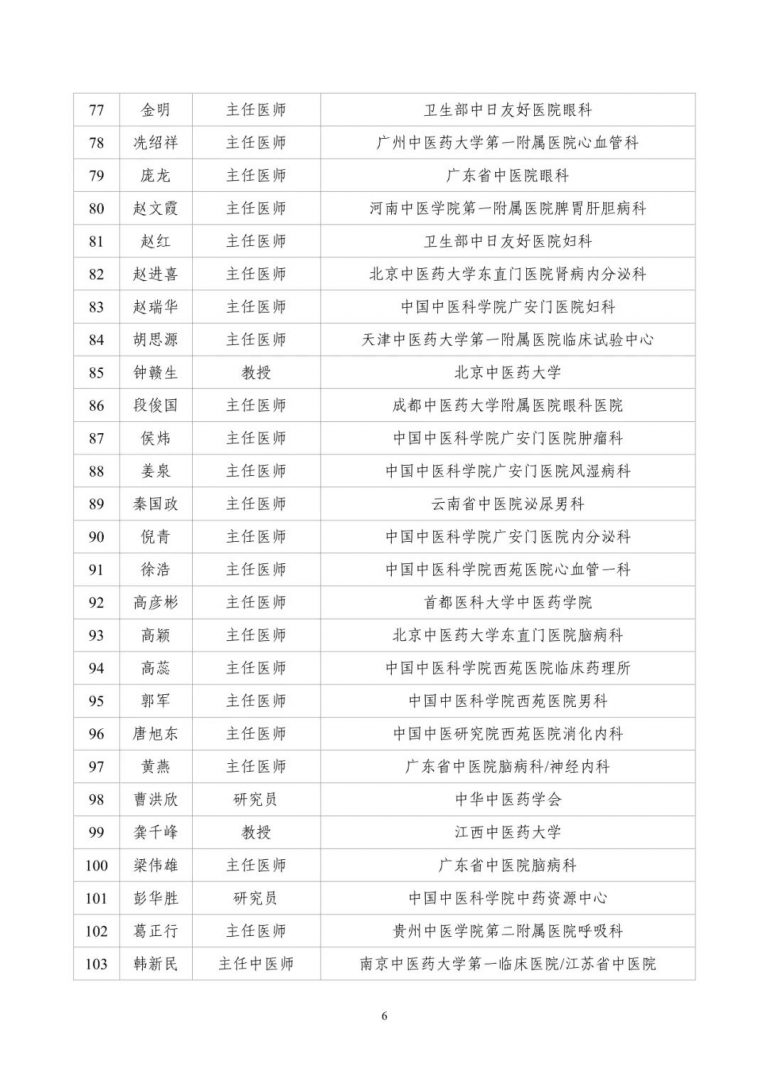
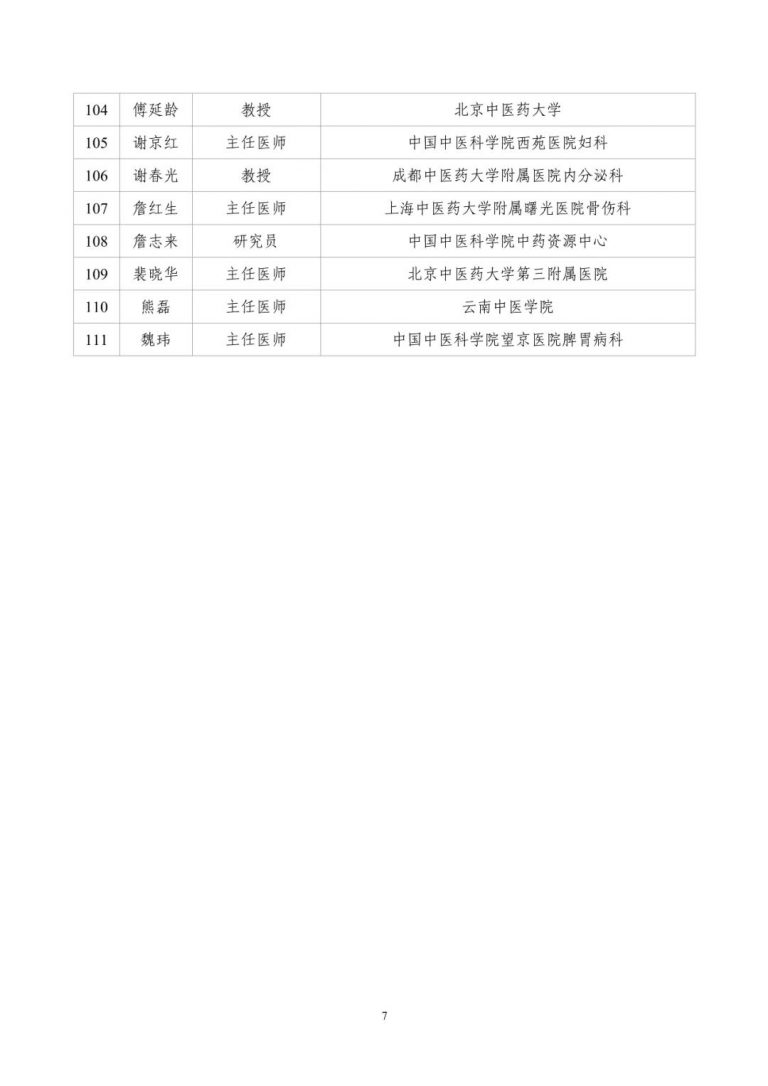
按照两局批复同意的《古代经典名方中药复方制剂专家审评委员会组建方案》,成立了由中医药院士、国医大师等权威专家组成的专家遴选组。经专家遴选组审议、挂网公示,并报两局同意,现将《古代经典名方中药复方制剂专家审评委员会委员名单(第一批)》(见附件1)予以发布。
特此通告。
附件:古代经典名方中药复方制剂专家审评委员会委员名单(第一批)
国家药监局药审中心
2022年4月25日
古代经典名方中药复方制剂及其物质基准申报资料要求(征求意见稿)
为落实《古代经典名方中药复方制剂简化注册审批管理规定》,规范古代经典名方中药复方制剂注册申报工作,国家药监局组织起草了“古代经典名方中药复方制剂及其物质基准的申报资料要求”(征求意见稿),现向社会公开征求意见。请于2019年4月15日前将有关意见以电子邮件形式反馈至国家药监局药品注册司。
电子邮箱:zhangtd@nmpa.gov.cn
国家药监局综合司
2019年3月22日
《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》发布
国家药品监督管理局药品审评中心发布《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》。
按古代经典名方目录管理的中药复方制剂属于中药注册分类3.1类(以下简称中药3.1类)。为传承精华,更好地开展中药3.1类的药学研究,制定该技术指导原则。技术指导原则主要围绕中药3.1类的特点阐述相关要求,明确中药3.1类药学研究的基本原则,内容主要包括药材研究、饮片研究、基准样品研究、制剂生产研究、制剂质量和质量标准研究、相关性研究、稳定性研究等方面。
以下内容来源:国家药品监督管理局药品审评中心官网
国家药监局药审中心关于发布《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》的通告
(2021年第36号)
在国家药品监督管理局的部署下,药审中心组织制定了《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》(见附件1)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
附件:
1.按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)
2.《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》起草说明
国家药监局药审中心
2021年8月27日